Определение коррозии
Дать определение коррозии можно с разных точек зрения. Наиболее общее утверждение с физико-химической — это процесс разрушения (деструктуризации) и утраты свойств элементами и веществами (сплавами) в результате воздействия факторов окружающей среды. В результате коррозии, которая по сути является окислительно-восстановительной реакцией, металл становится окислом (оксидом) благодаря взаимодействию с окислителем, в том числе с кислородом.
Что нужно знать о коррозии
При сборе и сдаче металлолома важно уметь определять коррозионные участки, чтобы исключать их из состава партии. Процесс может затрагивать не только поверхность. Тонкая пленка ржавчины на поверхности металла может быть безобидной поверхностной коррозией, а может говорить о глубоком внутреннем разрушении. Зная особенности коррозионных процессов, вы можете увереннее заниматься отбором пригодного для утилизации металла. Напоминаем, что все пораженные ржавчиной и коррозией материалы в скупку лома не принимаются. А коррозия — это не только ржавчина на стали.
С практической точки зрения нас больше интересует коррозия как процесс, приводящий к потере свойств, определяющих возможность использования металлов и сплавов в производстве и эксплуатации металлоконструкций. Коррозия стали, чугуна, цветных металлов и сплавов приводит к невозможности выполнять операции металлообработки с запланированным результатом — металл в таком состоянии нельзя плавить, ковать, механически обрабатывать, сваривать и каким-либо образом соединять в конструкции.
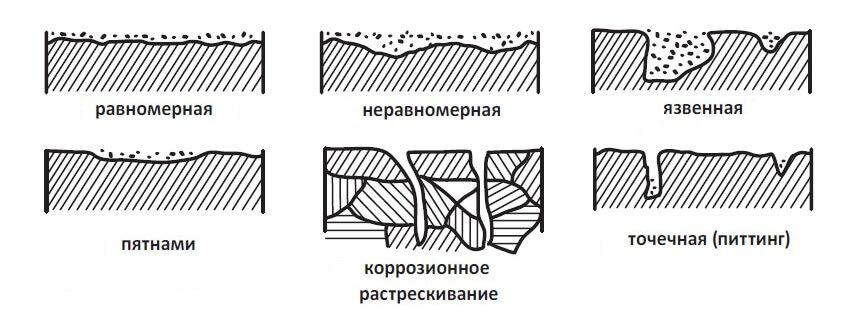
Виды коррозии металлов
Виды и типы коррозии металлов изучаются как химические и электрохимические процессы и как явления, развивающиеся в структуре материала. Структурно (физически и технологически) принято классифицировать коррозионные явления:
- по характеру распространения — площадь, проникновение;
- по механизму разрушения материала;
- по охвату поверхности — локально или тотально;
- по результату — последствиям течения процесса в металле с точки зрения его свойств и целостности.
Наблюдаемые и изученные явления разделены по признакам.
- Коррозия равномерная, неравномерная и избирательная охватывает либо всю наблюдаемую область, либо ее отдельные части, либо определенные области в зависимости от условий, например, в точках сварки или контакта разных металлов.
- Местная коррозия распространяется пятнами по отдельным участкам. Точечная и язвенная проявляется в виде небольших участков на поверхности или локальных углублений, провалов (язв).
- Более сложные коррозионные явления наблюдаются при межкристаллитном процессе, когда признаки возникают по границам металлических кристаллов.
- Растрескивающая коррозия приводит к образованию трещин, подповерхностная развивается в глубине. Поскольку трещины и отслоения образуют новые доступные для окислителей поверхности, процесс распространяется и на них, уходя в глубину структуры металла.
Причины возникновения коррозии в металлических сплавах и металлах, принято рассматривать с точки зрения химической и электрохимической. Внешне коррозия может выглядеть как рыжеватая пленка, точки и углубления коричневого цвета, слои хлопьев на металле, паутинка коричневых трещин.
Химическая коррозия металлов
В процессе химической коррозии происходит разрыв металлической связи, возникает новая связь между атомами металла и окислителя, что приводит к образованию нового и отличного от металла вещества — окисла. При химической коррозии не возникает протекания электрических токов внутри металла, так как ее вызывают окислители, не являющиеся электролитами. Принято различать газовую и жидкостную коррозию по агрегатному состоянию агента — окислителя. В результате химической коррозии некоторые металлы, например алюминий, могут образовывать достаточно прочную оксидную пленку на поверхности, а некоторые, например сталь, разрушаются.
Электрохимическая коррозия металлов
Процесс электрохимической коррозии протекает в присутствии электролитов, когда внутри металла возникают токи. Это анодные и катодные взаимодействия, обмен ионами и электронами с веществом деполяризатором.
В зависимости от среды, условий и коррозионных агентов принято различать коррозию:
- электролитическую (в присутствии электролита);
- атмосферную (в присутствии содержащих влагу газов), например, окисление железа на воздухе;
- почвенную при наличии в среде электролитов и значительного количества окислителей, в том числе кислорода при аэрации;
- аэрационную, при которой части металлоконструкции подвергаются окислению в местах контакта с воздухом;
- морскую и биологическую — в соленой воде и в присутствии бактерий, выделяющих окислители;
- электрическую — вызванную блуждающими токами от работы электрооборудования или присутствия электромагнитных наводок.
Методы защиты от коррозии металла
Наиболее распространенный и технологически доступный метод защиты от коррозии — использование покрытий для предупреждения развития процесса. Металлическое покрытие наносится в виде слоя более стойкого к коррозии металла, его принято классифицировать как анодное и катодное в зависимости от типа активности. Цинковое покрытие — анодное, медное или никелевое — катодное. Неметаллические покрытия — краска, грунтовка, специальные покрывающие составы, цементные смеси, битумы и органические смеси.
Химическая защита образуется за счет создания пленки методами оксидирования, фосфатирования, воронения (стали), цементации углеродом.
Электрохимическая защита строится на переносе коррозионной активности вовне, например, на металлический лом, окружающий нуждающийся в защите участок. Для этого применяется катодно-анодная схема подключения металлоконструкции и лома к источникам постоянного тока. Разновидность электрохимической защиты — протекторная, основанная на покрытии металлоконструкции слоем металла, который подвергается коррозии, отбирая активность от защищаемой части.
Изменение состава окружающей и коррозионной среды
В состав металла или его непосредственного окружения вводятся ингибиторы коррозии. Этот метод требует специального исследования условий, так как необходимо подбирать сложный комплекс веществ. Не всегда удается ввести ингибиторы в сам металл, при этом в среде эти вещества могут прореагировать с окружением и изменить свои свойства.

